
Полиморфизм генов преэклампсии и сосудистого тонуса. Предрасположенность к гипертоническим состояниям, нарушениям плацентарной функции, преэклампсии, инфаркту миокарда
Стоимость анализа
стоимость указана без учета стоимости забора биологического материала
Добавить в корзинуГотовность результатов анализа
Обычные*: 8-12 р.д.
Дата сдачи анализа:
Дата готовности при сдаче до 12:00:
*не считая дня сдачи.
Где и когда можно сдать
- Будни: с 7.45 до 21.00
- Выходные: с 8.45 до 17.00
Подготовка к анализу
Подготовка не требуется.
Забор биоматериала
Методы выполнения и тесты
ДНК-диагностика. ACE I/D rs1799752;ADD1 1378G>T (Gly460Trp) rs4961; AGT T+704C (Met235Thr) rs699; AGTR1 1166A>C rs5186; AGTR2 1675G>A rs1403543; CYP11B2 -344 C>T rs1799998; ESR1 -351A>G (XbaI) rs9340799; ESR1 -397T>C (PvuII) rs2234693; NOS3 VNTR (4b/4a); NOS3 G894T (E298D, Glu298Asp), rs1799983; NOS3 -786T>C, rs2070744; COX-2 -765G>C (rs20417
В этот блок анализов входят:
Для чего это нужно
Блок включает исследование полиморфизмов, ассоциированных с гипертоническими состояниями и предрасполагающими к развития сердечно-сосудистых заболеваний. Рекомендуется перед планированием или во время беременности для оценки прогноза развития невынашивания беременности, преэклампсии, фетоплацентарной недостаточности. Также анализ рекомендован перед назначением гормональной заместительной терапии (ГЗТ). Ранняя диагностика генетической предрасположенности к развитию заболеваний/состояний поможет своевременно назначить профилактику и/или лечение.
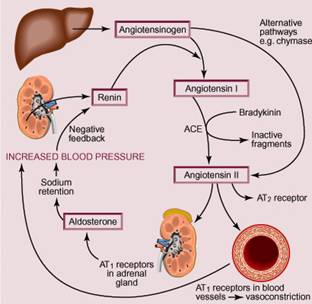
АПФ или ACE (angiotensin converting enzyme - ангиотензин-конвертирующий фермент) является одним из основных компонентов РААС (ренин-ангиотензин-альдостероновая система), осуществляющий превращение ангиотензина I в ангиотензин II, тем самым повышая артериальное давление. Ген ACE локализован в 17 хромосоме, кластере 17q23. Полиморфизм гена связан с наличием (вставка, insertion, I) или отсутствием (выпадение, deletion, D) 287-ми пар нуклеотидных оснований (Alu-вставка) в 16 интроне гена и получил название I/D полиморфизма.
Варианты полиморфизма и частота в европейских популяциях: I/I = 27,04%; D/D = 23,04%; и I/D = 49,92%, т.е. у половины популяции.
Полиморфизм гена ACE является структурным и изменяет экспрессию гена, приводя к изменению активности АПФ. При генотипе D/D концентрация АПФ в крови в 2 раза выше, чем при генотипе I/I, и, как следствие, к более высокой скорости превращения ангиотензина I в ангиотензин II. У гетерозигот I/D будет промежуточная концентрация ACE в крови.
У лиц с D/D генотипом повышен риск развития, прежде всего, сердечно-сосудистых заболеваний: артериальной гипертензии, инфаркта, ишемического и геморрагического инсульта, постинфарктных осложнений. Вариант I/I защищает от осложнений сахарного диабета 2 типа. Вариант D/D резко ухудшает прогноз при диабетической нефропатии. ACE - важный фермент в мышечной ткани, поэтому анализ на этот полиморфизм является одним из самых важных при отборе спортсменов. При варианте I/I хорошо переносятся длительные нагрузки. Вариант D/D способствует эффективному набору мышечной ткани, что подходит, например, для плавания.
I/D полиморфизм является одним из главных полиморфизмов, играющих существенную роль в генезе развития тяжелых осложнений беременности – преэклампсии, задержки роста плода, невынашивания беременности. Именно генотип D/D ассоциирован с риском преэклампсии, плацентарной недостаточночти и др. репродуктивных осложнений. Также было показано, что есть связь носительства варианта D/D и ультрачувствительного СРБ с осложнениями беременности. При наличии варианта D/D и нормального значения СРБ беременность проходила без особенностей. Если наличие варианта D/D и высокий СРБ – прогноз был резко неблагоприятный. При отсутствии генотипа D/D даже при повышенном СРБ никаких особенностей не наблюдалось.
α-аддуцин . ADD1 1378G>T (Gly460Trp) rs4961
В качестве вероятных маркеров артериальной гипертензии, кроме генов РААС, рассматривается ген ADD1 - ген α-аддуцина – белка, входящего в состав клеточной мембраны и участвующего в транспорте ионов натрия в клетках почечных канальцев. Замена G на T в 1378 положении гена (G1378T) приводит к замене в аминокислотной последовательности глицина на триптофан в положении 460: Gly460Trp=G460W.
Имеются данные о связи полиморфизма 1378 G>T гена ADD1 с развитием артериальной гипертензии и выраженностью ответа на терапию диуретиками. Наличие аллеля T в гетеро-и гомозиготе, ассоциировано с более высокой чувствительностью к изменениям натриевого баланса, а именно задержке натрия, что приводит (особенно при диете, богатой солью) к повышению риска артериальной гипертензии в 1,8 раза. Анализ может показывать генетическую предрасположенность к солечувствительной форме гипертензии.
Носители аллеля T показывают значительно сниженный риск инсульта и инфаркта при терапии тиазидными диуретиками.
Ангиотензиноген. AGT T+704C (Met235Thr) rs699
Ген AGT регулирует экспрессию ангиотензиногена, полипептида, в основном производимого печенью. Расщепление молекулы ангиотензиногена ренином приводит к образованию ангиотензиногена I, который затем превращается в ангиотензин II. А далее уже ангиотензин II связывается с рецептором и влияет тем самым на гомеостаз натрия и на сосудистое сопротивление, повышая артериальное давление. Ген AGT располагается на длинном плече 1-й хромосомы (1q42-43) и состоит из пяти экзонов и четырех интронов.
Схема ренин-ангиотензин-альдостероновой системы (РААС).
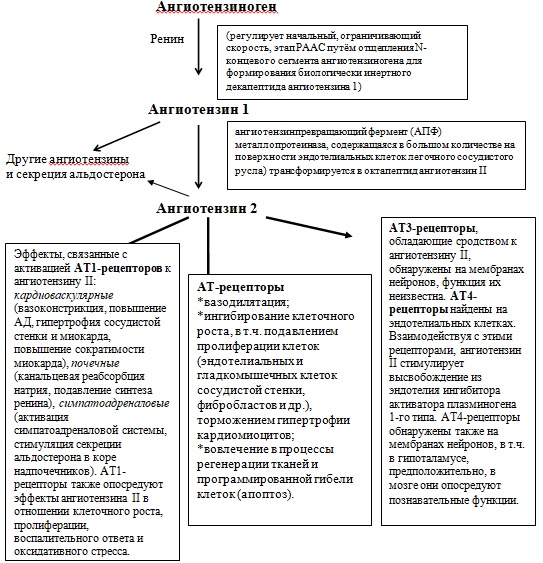
Полиморфизм гена AGT по минусовой цепи ДНК обозначается как T+704C, а по комплементарной плюсовой цепи замена выглядит как A>G. В результате замены нуклеотидов происходит аминокислотная замена Met235Thr. Это важнейший полиморфизм, отвечающий за риск гипертонической болезни и риск инфаркта миокарда. В акушерстве носительство такого полиморфизма, особенно в гомозиготной форме, резко повышает риск преэклампсии.
Ангиотензиноген синтезируется печенью и повышается в ответ на эстрогены, глюкокортикоиды, ожирение, курение, при сахарном диабете. Поэтому этот полиморфизм связан со многими рисками для здоровья при наличии сопутствующих факторов. В частности, он резко повышает риск развития диабетической нефропатии.
Замена аминокислот Met235Thr нефункциональная, однако этот полиморфизм находится в жесткой связке с другими полиморфизмами этого же гена AGT (например, rs5051), которые находятся в промоторной области гена и заставляют вырабатывать большее количество ангиотензиногена. Поэтому наличие полиморфизма AGT T+704C также связывают с высокими концентрациями ангиотензиногена в крови.
У европейской популяции полиморфизм встречается довольно часто. Наличие аллеля С повышает уровень ангиотензиногена и приводит к высоким концентрациям ангиотензина II, что и ведет к повышению артериального давления, инфакрту миокарда. У беременных повышается риск преэклампсии. У половины популяции (49,92%) имеется гетерозигота по полиморфизму T/C (= A/G), у которых наблюдается промежуточная концентрация ангиотензиногена в крови. При наличии гомозиготы T/T (=A/A) концентрация ангиотензиногена в крови адекватная.
Полиморфизмы генов ACE и AGT являются синергистами. Их одновременное обнаружение ассоциировано с повышенной активностью ренин-ангиотензиновой системы и резкому повышению рисков сердечно-сосудистых заболеваний, а у беременных – риску невынашивания беременности, преэклампсии и др.репродуктивных осложнений. Ангионензин II повышает синтез PAI-1, тем самым потенцируя неблагоприятное действие повышенных уровней PAI-1 при беременности. Поэтому неблагоприятными являются связки PAI-1 - ACE и PAI-1 – AGT.
Рецептор 1 типа для ангиотензина II. AGTR1 1166A>C rs5186
Ангиотензин II взаимодействует с двумя клеточными рецепторами ангиотензина 1-го и 2-го типов, кодируемых, соответственно, генами AGTR1 и AGTR2.
Ген ATGR1 находится на длинном плече 3-й хромосомы (3q21-25). Замена аденина (А) на цитозин (С) в позиции 1166 в регуляторной области гена AGTR1 приводит к усилению его экспрессии. В таком случае ангиотензин II, часто взаимодействуя со своими рецепторами 1 типа, повышает сосудистый тонус, задерживает натрий, при хронической стимуляции повышает пролиферацию соединительной ткани в стенке сосудов, тем самым повышая жесткость стенки артерий и приводя к повышению артериального давления.
Аллель С сочетается с гипертонией, ИБС, а у беременных – с преэклампсией и др.осложнениями беременности. По данным литературы у гетерозигот A/C риск гипертонии повышается в 1,4 раза, а у гомозигот C/C – в 7,3 раза(!). rs5186 ассоциирован не только с тяжелыми формами эссенциальной гипертензии, но и с резистентностью к антигипертензивной терапии. На большую выраженность риска гипертензии при rs5186 играет женский пол, возраст, ожирение. Отмечен синергический эффект генотипа ATGR1 CC с генотипом ACE DD (2% населения).
Рецептор 2 типа для ангиотензина II. AGTR2 1675G>A rs1403543
Ген ATGR2 находится на X-хромосоме. Рецепторы 2 типа оказывают противоположное действие: противостоят гипертензивному эффекту, блокируют гипертрофию соединительной ткани, усиливают выделение натрия с мочой. Взаимодействие ангиотензина II с рецепторами 2-го типа обусловливает снижение артериального давления. При варианте G полиморфизма rs1403543 рецепторы второго типа гораздо лучше сдерживают прессорные и пролиферативные эффекты ангиотензина II, чем при носительстве аллеля A. Носительство аллеля А, особенно в гомозиготной форме, является фактором, повышающим риск артериальной гипертензии, особенно на фоне высокого потребления соли, избыточного веса и инсулинорезистентности, а также предраспологающим к риску преэклампсии во время беременности. Особенно неблагоприятная связка с AGTR1 C/C.
Альдостерон-синтетаза. CYP11B2 -344 C>T rs1799998
Альдостерон-синтетаза - это фермент, который катализирует последнюю стадию синтеза альдостерона. Альдостерон - это гормон коры надпочечников, относящийся к группе минералокортикоидов. Он действует на почечные канальцы, заставляя их обратно забирать в кровь ионы натрия, тем самым повышая объем крови и способствуя повышению АД. Один из важных участников прямых и обратных связей ренин-альдостероновой системы. Локализация гена CYP11B2 - 8q21. Наличие аллеля С связано с повышением синтеза альдостерона, тем самым повышая риск гипертонии, особенно в гомозиготной форме CC. При беременности полиморфизм -344C/T ассоциирован с повышенным риском гипертензивных осложнений беременности, а следовательно – с риском фетоплацентарной недостаточности.
Рецептор эстрогена (эстрогеновый рецептор, рецептор эстрогенов альфа). ESR1 -351A>G (XbaI) rs9340799
Рецептор эстрогена (эстрогеновый рецептор, рецептор эстрогенов альфа). ESR1 -397T>C (PvuII) rs2234693
Синонимы гена ESR1: ER, ESR, ESRA
Эстрогены являются стероидными гормонами, синтезируемыми в яичниках, плаценте, коре надпочечников и в других тканях, и секретируемыми в кровь. Они играют важную роль и во время беременности, в т.ч. в подготовке эндометрия для имплантации зародыша. Многочисленные эффекты гормонов осуществляются через рецепторы эстрогенов. Эстрогеновые рецепторы (ERs) были впервые охарактеризованы в 1969 г., а в 1996 г. у человека были идентифицированы два типа рецепторов, названные ER-β и ER-α. ERs локали зованы на эндотелии, гладкомышечных клетках, участвующих в предотвращении эндотелиальной дисфункции, регулируют экспрессию прогестероновых рецепторов, что важно для течения беременности и регуляции родовой деятельности. В матке ER-α активирует пролиферацию и индуцирует экспрессию рецепторов прогестерона. Половые гормоны и их рецепторы могут играть определенную роль в метаболизме коллагена и поддержании целостности экстрацеллюлярного матрикса. Кроме того, ER- α играет ключевую роль в регуляции потребления пищи и расхода энергии эстрогенами.
Ген ESR1 кодирует рецептор эстрогена ER-α и локализуется на 6-й хромосоме в области q25.1. Он состоит из 8 экзонов, 7 интронов, его размер составляет более 140 т.п.о. Наиболее изученными полиморфизмами гена ESR1 являются -397С>Т (rs2234693), определяемый при расщеплении участка рестриктазой Pvull, и -351A>G (rs9340799), определяемый рестриктазой Xbal, локализованные в некодирующей области гена (интроне I). Оба полиморфизма приводят к снижению выработки эстрогенового рецептора ER- α. Следствием этого является повышение риска недифференцированной дисплазии соединительной ткани.
У мужчин наличие rs2234693 связывают с нарушениями сперматогенеза, со сниженной подвижностью сперматозоидов, а также с низкими показателями SHBG (ГСПГ), ЛГ, повышенными показателями ФСГ, свободного эстрадиола в крови.
У женщин оба этих полиморфизма могут приводить к репродуктивным нарушениям и акушерским осложнениям, в т.ч. давая неблагоприятный прогноз для осуществления ЭКО, повышая риски невынашивания беременности, а также к нарушениям кальциевого обмена, в частности снижая плотность костной ткани и повышая риск развития остеопороза. Также есть данные о связи полиморфизма -397T>C (PvuII) с предрасположенностью женщин к эндометриозу.
NO-синтаза (синтаза оксида азота). Полиморфизмы гена NOS3:
- NOS3 VNTR (4b/4a);
- NOS3 G894T (E298D, Glu298Asp), rs1799983;
- NOS3 -786T>C, rs2070744.
Ген NOS3 кодирует эндотелиальную синтазу оксида азота 3 типа (NOS3, eNOS), которая отвечает за синтез оксида азота NO клетками эндотелия. Существует несколько видов NO-синтаз, из которых эндотелиальная NO-синтаза синтезируется в эндотелии сосудов. При участии всех NO-синтаз происходит синтез оксида азота NO из аминокислоты L-аргинина.
Оксид азота (NO) принимает участие во множестве физиологических процессов. Так его синтез в клетках эндотелия регулирует тонус сосудов, кровоток и давление, а также контролирует адгезию тромбоцитов и пролиферацию гладкомышечных клеток. Снижение выработки оксида азота эндотелием приводит к развитию эндотелиальной дисфункции и повышению артериального давления. Также NO влияет на ангиогенез (процесс образования и роста новых сосудов) и свертывание крови. Во время беременности оксид азота влияет на имплантацию, децидуализацию, регуляцию кровотока в плаценте. В оптимальной концентрации NO стимулирует процессы внутриутробного развития; в то же время его дефицит приводит к остановке развития эмбриона, а избыток вызывает дегенерацию зародыша.
Ген NOS3 находится на хромосоме 7 в положении 7q36.1. К настоящему времени в данном гене описано 11 полиморфизмов, но наиболее изученными являются полиморфизм VNTR (4b/4a) в интроне 4, полиморфизм 894G>T в 7-м экзоне (rs 1799983) и полиморфизм -786T>C промотора гена NOS3.
Полиморфизм NOS3 VNTR (4b/4a) имеет несколько названий: c.582+353_379del, 27bp VNTR intron4, аллели 5R/4R, 27-bp repeat 4b/a, ecNOS 4a/4b (Endothelial Constitutive NOS), eNOS 4a/4b, NOSIII, NOS3-intron-4-VNTR, EC-NOS, cNOS, rs61722009, rs869109213.
Полиморфизм представляет собой выпадение одного тандемного повтора (VNTR - variable number tandem repeats) из 27 нуклеотидов в некодирующей области гена. В различных популяциях показано существование не менее пяти аллелей: с 2, 3, 4, 5 и 6 повторами. Однако полиморфизм NOS3-VNTR характеризуется как двух-аллельный, поскольку наиболее часто встречаются аллели с четырьмя и пятью повторами, которые были названы 4a (4R; 4N) и 4b(5R; 5N) соответственно. Неблагоприятным вариантом является аллель 4a, особенно в гомозиготной форме (4a/4a). Частота встречаемости неблагоприятного варианта гена – 16-18%.
При носительстве аллеля 4a (4R), особенно в гомозиготной форме (4a/4a), уровень продукции эндотелиальной NO-синтазы снижен, что является фактором повышенного риска развития атеросклероза, ишемической болезни сердца и инфаркта миокарда, а также сосудистых осложнений при сахарном диабете типа 1 и 2.
NOS3 G894T (E298D, Glu298Asp), rs1799983. Замена в нуклеотидной последовательности G на T в 894-м положении приводит к замене в аминокислотной последовательности глутамина на аспарагин в 298-й позиции. В результате чего снижается концентрация оксида азота. Наличие неблагоприятного аллеля T связывают с повышенным риском развития артериальной гипертонии, ИБС, инфаркта миокарда, различных нарушений проводимости сердца. Есть данные, что полиморфизм может провоцировать повышение концентрации гомоцистеина в плазме у здоровых некурящих людей с дефицитом фолиевой кислоты. Гипергомоцистеинемия является независимым дифференцированным фактором риска сердечно-сосудистых заболеваний. Также аллель T ассоциирован с риском развития болезни Альцгеймера. Частота встречаемости аллеля T в европейской популяции составляет около 32%.
NOS3 -786T>C, rs2070744. Замена происходит в промоторной области. Аллель C ассоциирован с риском атеросклероза, инфарктом миокарда и спазмом коронарной артерии. Доказана также связь мутации с риском развития ревматоидного артрита и прогрессированием рака предстательной железы, однако наличие мутации не является причиной его возникновения.
Все три полиморфизма гена NOS3 ассоциированы с фетоплацентарной недостаточностью у беременных в результате снижения уровня оксида азота и, соответственно, нарушения вазодилатации сосудов. Полиморфизм NOS3 G894T связывают с риском отслоения плаценты и развития гипертонии во время беременности. Выявлена связь полиморфизма NOS3 VNTR с привычным невынашиванием беременности и задержкой внутриутробного развития плода.
COX-2 -765G>C (rs20417)
COX-2 -765G>C (rs20417)). rs20417, также известный как -765G>C (и -899G> C в некоторых более ранних публикациях), представляет собой однонуклеотидную замену в гене PTGS2 эндопероксидазы синтазы 2 простагландина (циклооксигеназы-2) в хромосоме 1.
Полиморфизм ассоциирован с повышенной активностью тромбоцитов, неудачами имплантации, развитием преэклампсии.
Смотрите также
Мутация в гене ACE (ангиотензин-превращающего фермента)Мутация АСЕ. Что делать? Отвечает И.И. Гузов:
Также спрашивают:
- ToRCH-комплекс (комплекс анализов «Антитела к инфекциям, беременность») (определение уровня в крови)
- Базовая коагулограмма/гемостазиограмма
- Биохимический анализ крови, расширенный
- Блок анализов на ВИЧ, сифилис, гепатиты В и С
- Блок аутоантител
- Группа крови, резус-фактор (определение в крови)
- Общий анализ мочи (с микроскопическим исследованием осадка)
- Полиморфизм генов гемостаза 4 фактора - лейденская мутация (мутация фактора V), мутация гена протромбина, мутация MTHFR, мутация PAI-I
С этим анализом сдают:
- Гомоцистеин (определение уровня в крови)
- Иммунограмма (иммунный статус)
- Общий анализ крови (ОАК, с лейкоцитарной формулой и СОЭ)
- Полиморфизм генов гемостаза 4 фактора - лейденская мутация (мутация фактора V), мутация гена протромбина, мутация MTHFR, мутация PAI-I
- Полиморфизм генов системы гемостаза, системы фибринолиза и метаболизма фолатов, 23 фактора (ассоциированных с невынашиванием беременности, нарушениями плацентарной функции, неудачными попытками ЭКО и бесплодием неясного генеза)
- Полиморфизм генов цитокинов (цитокиновый профиль, иммунная конституция человека)
- Расширенная гемостазиограмма
- Факторы риска заболеваний сердечно-сосудистой системы: (COX2), (hANP), (EDNI), (NOS3(e)-298), (NOS3(e)-V)
Как сдать анализы в Лабораториях ЦИР?
Для экономии времени оформите заказ на анализ в Интернет-магазине! Оплачивая заказ онлайн, Вы получаете скидку 7% на весь оформленный заказ!
У Вас есть вопросы? Напишите нам или позвоните +7 (495) 514-00-11. По анализам Вы можете задать вопрос на нашем форуме и обратиться на консультацию к специалисту.
Материалы по теме
-
 Прямой эфир с экспертом ЦИР Светланой Николаевной Дементьевой 10 апреля в 15:00 Тема: От анализов к колыбели: гармония планирования беременности для двоих Эфир будет доступен на всех каналах ЦИР
Прямой эфир с экспертом ЦИР Светланой Николаевной Дементьевой 10 апреля в 15:00 Тема: От анализов к колыбели: гармония планирования беременности для двоих Эфир будет доступен на всех каналах ЦИР -
 ПРЯМОЙ ЭФИР С ЭКСПЕРТОМ ЦИР Игорем Ивановичем Гузовым 17 марта в 14:30 Тема: Экспертный подход к диагностике и лечению бесплодия Эфир доступен в записи Подписаться на Чат ЦИР
ПРЯМОЙ ЭФИР С ЭКСПЕРТОМ ЦИР Игорем Ивановичем Гузовым 17 марта в 14:30 Тема: Экспертный подход к диагностике и лечению бесплодия Эфир доступен в записи Подписаться на Чат ЦИР -
 ПРЯМОЙ ЭФИР С ЭКСПЕРТОМ ЦИР Оксаной Валерьевной Тимофеевой 11 марта в 13:00 Тема эфира: Ведение беременности при обнаружении АТ, ассоциированных с синдромом Шегрена. Клинические случаи. Эфир доступен в записи Подписаться на чат ЦИР
ПРЯМОЙ ЭФИР С ЭКСПЕРТОМ ЦИР Оксаной Валерьевной Тимофеевой 11 марта в 13:00 Тема эфира: Ведение беременности при обнаружении АТ, ассоциированных с синдромом Шегрена. Клинические случаи. Эфир доступен в записи Подписаться на чат ЦИР -
 31 января в 16:30 проведём прямой эфир с акушером-гинекологом, гемостазиологом Анной Игоревной Дрожжиной. Тема эфира: Репродуктивное старение Обсудим факторы, влияющие на количественное и качественное истощение овариального резерва, как это влияет на циклическую функцию яичников...
31 января в 16:30 проведём прямой эфир с акушером-гинекологом, гемостазиологом Анной Игоревной Дрожжиной. Тема эфира: Репродуктивное старение Обсудим факторы, влияющие на количественное и качественное истощение овариального резерва, как это влияет на циклическую функцию яичников... -
 ПРЯМОЙ ЭФИР С ЭКСПЕРТОМ ЦИР Оксаной Валерьевной Тимофеевой доступен в записи. Смотреть эфир
ПРЯМОЙ ЭФИР С ЭКСПЕРТОМ ЦИР Оксаной Валерьевной Тимофеевой доступен в записи. Смотреть эфир -
 ПРЯМОЙ ЭФИР С ЭКСПЕРТОМ ЦИР Оксаной Валерьевной Тимофеевой Тема: Три истории пациенток. Ответы на вопросы Эфир доступен в записи
ПРЯМОЙ ЭФИР С ЭКСПЕРТОМ ЦИР Оксаной Валерьевной Тимофеевой Тема: Три истории пациенток. Ответы на вопросы Эфир доступен в записи -
 ПРЯМОЙ ЭФИР С ЭКСПЕРТОМ ЦИР Дементьевой Светланой Николаевной 12 декабря 15:00 Тема: НЕпривычное невынашивание Эфир доступен в записи
ПРЯМОЙ ЭФИР С ЭКСПЕРТОМ ЦИР Дементьевой Светланой Николаевной 12 декабря 15:00 Тема: НЕпривычное невынашивание Эфир доступен в записи -
 Врач акушер-гинеколог А.А. Гамит в журнале «9 месяцев» рассказывает о причинах и лечении артериального давления у беременных.
Врач акушер-гинеколог А.А. Гамит в журнале «9 месяцев» рассказывает о причинах и лечении артериального давления у беременных. -
 Подводим итоги и приглашаем к сотрудничеству.
Подводим итоги и приглашаем к сотрудничеству. -
 Председатель заседания - генеральный директор ЦИР, врач акушер-гинеколог, к.м.н.Игорь Иванович ГУЗОВ.
Председатель заседания - генеральный директор ЦИР, врач акушер-гинеколог, к.м.н.Игорь Иванович ГУЗОВ.
Стоимость анализа
стоимость указана без учета стоимости забора биологического материала
Добавить в корзинуГотовность результатов анализа
Обычные*: 8-12 р.д.
Дата сдачи анализа:
Дата готовности при сдаче до 12:00:
*не считая дня сдачи.
Где и когда можно сдать
- Будни: с 7.45 до 21.00
- Выходные: с 8.45 до 17.00
Подготовка к анализу
Подготовка не требуется.
Забор биоматериала
Методы выполнения и тесты
ДНК-диагностика. ACE I/D rs1799752;ADD1 1378G>T (Gly460Trp) rs4961; AGT T+704C (Met235Thr) rs699; AGTR1 1166A>C rs5186; AGTR2 1675G>A rs1403543; CYP11B2 -344 C>T rs1799998; ESR1 -351A>G (XbaI) rs9340799; ESR1 -397T>C (PvuII) rs2234693; NOS3 VNTR (4b/4a); NOS3 G894T (E298D, Glu298Asp), rs1799983; NOS3 -786T>C, rs2070744; COX-2 -765G>C (rs20417
